우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.

KAIST 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
▲(왼쪽부터) 바이오및뇌공학과 박지호 교수, 에린 파간 석사과정
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
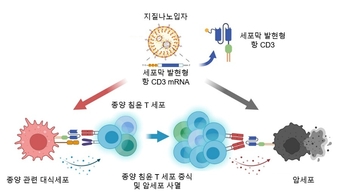
그림 1. 세포막 발현형 항 CD3 mRNA 지질나노입자를 통한 종양 침윤 T세포 증식 및 암세포 사멸 전략 모식도
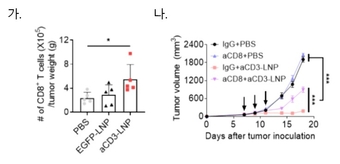
그림 2. 마우스 흑색종 모델에서 개발된 mRNA 치료제 주입 후 CD8+ 종양 침윤 T세포 수 증가 및 CD8+ 종양 침윤 T세포 의존적 종양 성장 억제 확인
