서론
현대의학에 대한 지나친 기대감 때문일까? 진료실에서 툭툭 던져지는 환자들의질문에 답을 구하다 보면 노화의 과정도 진단하고 치료할 수 있어야 할 것 같다. 이와 같은 환자와 의사들의 소망에도 불구하고 노화현상을 객관적으로 평가하여 진단하고 치료하는 것을 어렵게 하는 근본적인 몇 가지 딜레마가 있는데 노화는 질환이 아니며, 아직 결론이 내려진 믿을만한 노화의 이론이 없고 , 특정한 증상이 있지 않고, 믿을만한 진단도구가 없다는 점이다. 현재까지 우리가 이해하고 있는 노화과정의 가장 핵심은 내분비 기능의 변화이며, 그 중 가장 특징적인 것 중의 하나가 남성호르몬의 감소이다.
대사증후군은 복부 비만, 인슐린 저항성, 이상 지질 혈증, 고혈압을 특징으로 하는 광범위한 개명의 질환군으로 고령화 사회로 급격히 진입하고 있는 우리나라의 의료 환경에서는 특히 중요한 개념이다. 대사증후군을 일으키는 첫 번째 병리 현상으로 비만을 들 수 있는데 특히 복부비만은 근육량 감소와 함께 남성호르몬의 감소와 밀접하게 연관되어 있는 것으로 알려져 중요한 학문적 관심의 대상이 되어가고 있다. 이에 저자는 지금까지 이루어진 이 분야의 자료들을 토대로 현재의 시점에서 남성갱년기(후기발현 남성 성선기능저하증; Late Onset Hypogonadism)과 대사증후군의 상관관계에 대해 알아보고자 한다.
본론
남성갱년기 개념의 역사적 배경과 정의 고환기능의 감소와 노화의 연관성에 대해 19세기말 Brown-Sequard가 개와 돼지의 고환 추출물을 자가 주사한 후 근력과 지적능력의 향상을 경험했다고 보고하면서 급격히 촉발되어, 1930년대에는 동물모델을 이용한 자가고환이식기법이 도입되었고 이어서 테스토스테론과 안드로스테론의 분리에 성공, 이로 인해 1939년 Butenandt와 Ruzicka에게는 노벨화학상의 영예가 주어졌다. 같은 해 Werner는 50대남성에서 신경과민, 우울증 , 기억력 및 집중력 감퇴, 쉬 피로해짐, 불면증, 현기증, 안면홍조 , 발한, 성욕감퇴 등의 증상 증후군이 나타난다고 하여 이러한 현상을 남성갱년기(male climacteric)이라고 명명하였다.
여성의 폐경기(menopause)와 대칭적인 의미에서 andropause, male menopause라는 용어도 사용된 적이 있으나 남성은 여성처럼 폐경기를 계기로 생식력이 중단되지 않고 증상의 발현도 개인에 따른 차이가 많기 때문에 거의 사용되지 못하였다.
그후 이런 점을 보완한 용어로서 Partial Androgen Deficiency in Aging Male(PADAM), AndrogenDecline in Aging Male(ADAM) 등이 국제 학회에서 널리 사용되기도 하였다. 꽤 오랫동안 명확한 학술적 정의와 충분히 확립된 연구결과가 부족한 상태에서 남성호르몬보충요법이 시도되어 왔는데, 2002년 마침내 International Society for the Study of Aging Male(ISSAM)은 후기 발현 남성 성선기능저하증 혹은 남성갱년기 증후군은 남성에서 연령이 증가하면서 경험하게 되는 전형적인 증상들과 혈청 테스토스테론 결핍을 동반하는 임상적 생화학적 증후군이며 이 증후군은 삶의 질을 저하시키고, 여러 신체 기관의 기능에 부정적인 영향을 초래할 수 있다고 정의하고 임상증상, 진단, 치료에 관한 몇 가지 중요한 결론을 내리게 되었다.
최근 ISSAM, International Society of Andrology(ISA), European Association of Andrology(EAU), Sexual Medicine Society of North America(SMSNA)와 같은 학술 단체와 세계보건기구(WHO), 미국립보건원(NIH), 미국립의학
원(IOM)과 같은 기관들의 관심과 지원 가운데 그간 남성갱년기의 개념으로 받아 들여지던 남성의 노화와
호르몬에 관한 연구들을 재정리하여 새로운 정의를 내리고 많은 학문적 연구가 이루어지고 있다.
테스토스테론과 노화
노화가 진행함에 따라 테스토스테론은 생산과 생체이용도가 떨어지게 되는데 이는 시상하부-뇌하수체-고환 축의 각 수준의 노화에 따른 변화에 기인할 것으로 여겨진다. 노화가 진행함에 따라 고환의 라히디히 세포의 수는 감소하고, 황체화호르몬에 대한 반응도 떨어지게 되며, 황체화호르몬과 human chorionic gonadotropin(hCG) 자극에 대한 반응성이 떨어지게되어 결과적으로 테스토스테론 생성의 효율성이 감소하게 된다.
뇌하수체는 테스토스테론과 그 대사물의 되먹이 자극에 대해 더 민감해 지기때문에 순환 혈액 내의 테스토스테론 감소는 황체화호르몬의 보상성 증가를 항상 일으키진 않는다. 오히려 황체화호르몬 분비호르몬(LHRH)의 박동성 분비도 감소되어 뇌하수체의 황체화호르몬 생성은 더억제되고 노화는 결과적으로 테스토스테론의 박동성 분비의 약화를 초래하게 된다.
나이가 듦에 따라 성호르몬 결합 글로불린은 일반적으로 증가하게 되는데 이는 일차적으로 유리형 테스토스테론의 감소를 일으키지만 비만이나 고인슐린 혈증의 경우에는 오히려 순환 혈액 내 성호르몬 결합 글로불린을 억제를 통해 균형을 유지한다. LOH는 고전적 저성선증과는 구별되는 저성선증으로서, 시상하부의 GnRH분비의 저하와 뇌하수체 및 시상하부에서 테스토스테론에 대한 되먹임의 민감도증가, 고환에서의 테스토스테론생선능의 저하가 결합된 형태로 나타난다.
노화로 인한 총 테스토스테론치의 감소는 55~60세 (0.8%/year)에 이르러 유의하게 나타나고 75세에는 30세의 60%정도로 감소되며, 상대적으로 성호르몬 결합 글로불린는 증가하게 되는데 이는 성장호르몬 및 Insulin like growth factor-1(IGF-1)의 감소와 연관이 있는 것으로 알려지고 있다. 성호르몬 결합 글로불린의 증가는 결과적으 로 유리테스토스테론의 감소를 초래한다. 유리테스토스테론의 감소는 총 테스토스테론의 감소보다 더 일찍 일어나고 더욱 현저하여(1.4%/year) 75세에는 30세의 40% 밖에 되지않는다. 이와 같이 노화는 테스토스테론분비 조절의변화, 생성의 변화, 전달과 대사의 변화, 안드로겐 수용체의 변화를 일으키며 이런 변화의 결과는 성기능, 골대사, 근육 및 체형, 심혈관계, 전립선, 뇌조직 등에서 노화와 관련된 증상으로 발현된다.
테스토스테론과 비만
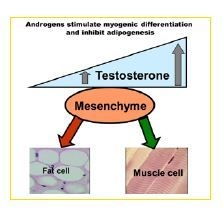
테스토스테론은 지방조직에 직간접적으로 작용하는데, 특히 테스토스테론이 지방세포 분화에 직접 작용한다. 그 기전은 노령의 지방조직일수록 증가하는 II-βHSD 효소의 발현이 테스테스테론이 낮을수록 더욱 증가한다. 안드로겐 결핍이 있는 비만한 남성에서 고렙틴증이 동반되는데 테스토스테론 투여 후 렙틴 감소와 더불어 지방량이 감소된다 는 연구 사실이렙틴과 저성선증과 비만의 관련성을 설명하는 증거이기도 하다. pleuripotent cell이 지방세포 및 근육세포로 변화되는 과정에서 테스토스테론 투여는 지방세포보다는 근육세포로의 분화를 유도하고 반대로 테스토스테론 수용체 길항제를 투여하면 근육세포 보다는 지방세포로 더 많이 분화된다. 이러한 여러 증거들은 지방세포에서 분비되는 렙틴과의 상호조절을 통해 우리 몸의 지방 조직을 조절한다는 것을 보여준다.
테스토스테론이 근육조직에 미치는 영향으로 근육강화, 기능향상, 근육량의 증가가 있다. 테스토스테론의 표적 목표는 해부학적으로는 근육량 유지, 생리학적으로는 단백질 합성 촉진, 파괴방지, 세포 분자수준에서는 테스토스테론의 수용체를 통한 근육세포로의 분화 및 세포핵 내의 테스토스테론의 수용체의 발현 촉진 증가이다. 따라서 LOH 환자의 지방량증가 및 근육량이 저하되는 생리상황이 테스토스테론의 감소를 중심으로 이루어짐을 알 수 있다.
따라서 남성 호르몬의 감소는 LOH 환자의 체형변화의 주요 원인이며 특히 LOH에 따르는 지방량의 절대적 또는 상대적 증가가 대사증후군의 중요 원인으로 작용할 수 있다는 것을 시사한다.
남성갱년기증후군과 대사증후군의 역학
테스토스테론은 근육의 증식을 유발한다. 그러므로 남성호르몬의 감소는 근육의 감소와 신체활동의저하를 초래한다. 나이가 들어감에 따라 점차 지방량은 증가하고 근육 및 뼈의 양은 줄어들어 점차 몸의 활력이 약해진다. 따라서 남성호르몬감소와 대사증후군과의 관계를 규명할 필요가 있다. 핀란드에서 이루어진 연구 결과에 의하면 대사질환이 있는 남성을 11년간 추적 검사한 결과 대사증후군이 있는 중년의 남성이 11년 후 그렇지 않은 남성보다 테스토스테론이 더욱 감소되었다. massachusetts males aging study (MMAS) 연구 결과는 초기 테스토스테론이 낮은 남성에서 11년 추적 후 당뇨 및 대사질환이 발병률이 50% 이상이었다. 이 두 가지 연구는 혈중 총 테스토스테론이 낮거나 대사질환이 있는 남성은 나이가 들수록 그렇지 않은 남성에 비해 대사성 질환 유병률이 높아진다는 즉, 테스토스테론 결핍과 대사질환은 매우 밀접한 관계가 있는 것을 보여준다.
Baltimore longitudinal study of ageing 연구는 테스토스테론과 중노년의 체구성 성분 변화를 종적으로 추적 관찰한 결과로 인슐린저항성과 테스토스테론과 관계를 분석했는데 중노년 남성에서 테스토스테론의 결핍은 우리 몸의 체구성 성분 중 지방의 양이 증가하고 이에 따르는 인슐린저항성의 유병률과 관계가 있음을 시사하였다.
우리나라의 남성에서도 노령화 인구 중에서 복부에 지방량이 전체 체형에 비해 확연히 증가되고 있다는 사실과 체지방의 또 다른 요소인 골밀도 역시 남성의 연령증가와 더불어 점진적으로 감소되고 인체
의 활력 을 조성하는 근육의 양과 근력이 떨어지는 사실은 이미 잘 알려져 있는 바이다.
호르몬보충요법
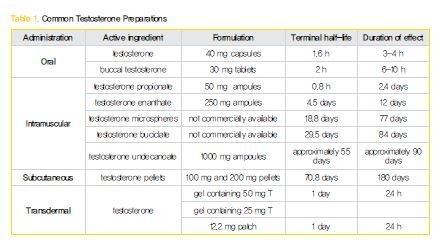
최상의 호르몬 보충요법은 생리적 상태와 가장 근접하게 보충해주는 것이 목표이다. 그러기 위해서는 생리적 적정농도 이상으로 올라가지 않으며, 충분한 작용시간, 안전하며, 효과적이며, 사용하기 간편하고, 가격이 싸면서, 국소부작용이 적어야 할 것이다. 현재 다양한 남성호르몬 제제가 시판되고 있으며 그나름대로 여러 가지 장단점이 있다(Table 1). 일반적으로 호르몬보충요법의 적응증이 분명한 성선저하증이 있는 젊은 환자에서는 작용시간이 긴 약제가 , 부작용 등으로 치료를 중단할 수도 있는 고령의 환자에서는 작용기간이 짧은 약제가 더 선호된다.
결론
병태생리 연구뿐만 아니라 역학조사 결과를 통해서도 잘 알려진 대로 테스토스테론이 부족해지는 남성갱년기(후기발현 성선기능저하증) 남성에서 지방조직이 증가하고 복부비만의 빈도가 높다. 아직까지 그 병태생리기전이 완전히 밝혀져 있지 않지만, 대사증후군은 중심성 비만과 인슐린저항성이 가장 중요한 원인으로 여겨지고 있다. 따라서 현재까지 밝혀진 연구 결과를 토대로 해석할 때 대사증후군의 핵심인 비만과 남성갱년기는 밀접한 병인론적 상관관계가 있다고 볼 수 있다. 그러므로 대사성증후군이 있는 남성호르몬이 감소되어 있는 남성갱년기 환자에서 생리적 상태와 가장 근접하게 보충해주는 것이 이런 환자의 치료에 있어서 중요한 옵션이 될 수 있다.

