유전자를 켜고 끈다는 것은 마치 전등 스위치를 올리고 내리듯, 세포 속 유전자의 작동 여부를 조절하여 켜면 단백질이나 물질 생산이 활발해지고, 끄면 생산이 억제된다. 한국 연구진이 기존에 ‘끄는 기능’에 치중됐던 한계를 넘어, 유전자를 켜고 끄는 것을 동시에 구현할 수 있는 혁신적 시스템을 세계 최초로 개발하며 합성생물학 기반 바이오산업의 새로운 패러다임을 열었다.

KAIST 공학생물학대학원(생명과학과 겸임) 이주영 교수와 국가과학기술연구회(이사장 김영식) 산하 한국화학연구원(원장 이영국) 노명현 박사 공동연구팀이 대장균에서 원하는 유전자를 동시에 켜고 끄는 것이 가능한 새로운 이중모드 크리스퍼(CRISPR) 유전자 가위 시스템을 개발했다고 밝혔다.
▲왼쪽부터 KAIST 생명과학연구소 문수영 박사, 공학생물학대학원(생명과학과 겸임)이주영 교수,
한국화학연구원 노명현 박사, 생명과학과 안난영 연구원
대장균은 실험이 쉽고 산업적 활용으로 바로 이어질 수 있는 대표적인 미생물이다. 한편, 유전자 가위(CRISPR) 기술은 21세기 생명공학의 가장 혁신적인 도구로 평가받고 있다.
특히 합성생물학의 기반이 되는 박테리아는 구조가 단순하고 빠르게 증식하면서도 다양한 유용 물질을 생산할 수 있다. 따라서 박테리아에서의 유전자 활성화는 ‘미생물 공장’을 설계하는 핵심 기술로, 산업적 가치가 매우 크다.
합성생물학의 핵심은 생명체의 유전자 회로를 프로그래밍하듯 설계해 원하는 기능을 수행하도록 만드는 것이다. 마치 전자회로에서 스위치를 켜고 끄듯, 특정 유전자는 활성화하고 다른 유전자는 억제해 대사경로를 최적화하는 기술이 필요하다. 연구팀이 개발한 이중모드 유전자 가위는 바로 이러한 정밀한 유전자 조절을 가능하게 하는 핵심 도구다.
기존 유전자 가위(CRISPR)는 주로 ‘끄기(억제)’ 기능에 특화되어 유전자 발현을 막는 데는 뛰어났지만, 반대로 유전자를 켜는 기능은 매우 제한적이었다.
또한 CRISPR가 작동하려면 특정 DNA 인식 서열(PAM, protospacer adjacent motif)이 필요한데, 기존 시스템은 PAM 인식 범위가 좁아 조절할 수 있는 유전자의 폭이 제한적이었다.
게다가 진핵세포(사람·식물·동물 세포)에서는 CRISPR 기반 활성화(CRISPRa)가 어느 정도 발전했지만, 박테리아에서는 내부 전사조절 메커니즘 차이로 유전자 ‘켜기’가 제대로 되지 않는 한계가 있었다.
연구팀은 이 한계를 극복하고자 표적을 확장하여 더 많은 유전자에 접근 가능하도록 하고 대장균 단백질을 활용하여 유전자 활성화 성능을 대폭 향상하였다.
그 결과, 기존에는 “끄는 것 위주”였던 유전자 가위가, 이번에는 켜기와 끄기를 동시에 제어할 수 있는 시스템으로 발전하게 된 것이다.
개발된 시스템의 성능 검증 결과는 매우 인상적이었다. 유전자를 켜는 실험에서는 최대 4.9배까지 발현량이 증가했고, 끄는 실험에서는 83%까지 억제할 수 있었다.
더욱 놀라운 것은 두 개의 서로 다른 유전자를 동시에 조절할 수 있다는 점이었다. 실제로 한 유전자는 8.6배 활성화하면서 동시에 다른 유전자는 90% 억제하는 데 성공했다.
연구팀은 이 기술의 실용성을 입증하기 위해 항암효과가 있는 보라색 색소인 ‘바이올라세인’ 생산량 늘리기에 도전했다. 대장균의 모든 유전자를 대상으로 하는 대규모 실험을 통해 바이올라세인 생산에 도움이 되는 유전자들을 찾아냈다.
그 결과, 단백질 생산을 도와주는 ‘rluC’ 유전자를 켜면 2.9배, 세포를 분열하고 나누어지도록 하는 ‘ftsA’ 유전자를 끄면 3.0배 생산량이 늘어났다. 두 유전자를 동시에 조절했을 때는 더욱 큰 시너지 효과가 나타나 무려 3.7배의 생산량 증가를 달성했다.
한국화학연구원 노명현 박사는 “박테리아에서도 정밀한 유전자 활성화가 가능해졌다”며 “합성생물학 기반 바이오산업 발전에 크게 기여할 것”이라고 말했다.
이주영 교수는 “이번 연구는 유전자 가위와 합성생물학을 결합해 미생물 생산 플랫폼의 효율을 크게 높인 성과”라며 “하나의 시스템으로 복잡한 유전자 네트워크를 제어할 수 있어 새로운 연구 패러다임을 제시했다”고 밝혔다. 또한 “이번 기술은 다른 박테리아 종에서도 작동이 확인돼, 바이오 의약품·화학물질·연료 생산 등 다양한 분야에 활용될 수 있다”고 덧붙였다.
KAIST 생명과학연구소 문수영 박사후 연구원이 제1 저자인 이번 연구 결과는 분자생물학 분야 최고 권위지인 ‘Nucleic Acids Research'에 지난 8월 21일 온라인 게재됐다.
한편, 이번 연구는 과학기술정보통신부 한국연구재단과 보스턴코리아 공동연구개발 사업의 지원으로 수행됐다.
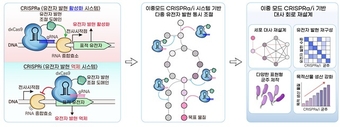
(좌) 이중모드 CRISPR 유전자 가위의 원리. 가이드 RNA(gRNA)가 표적 서열에 결합하면, dxCas9-CRP가 전사 시작점 주변에서 RNA 중합효소의 결합을 촉진(CRISPRa) 하거나 저해(CRISPRi)하여 유전자 발현을 정밀하게 제어한다. (중) 대장균의 전체 유전자를 대상으로 한 대규모 스크리닝으로 목표 물질 생산 최적화를 위한 핵심 조절 표적 위치들을 탐색하고, 유전자 발현의 활성화·억제를 동시에 조절하여 목표 물질 생산 대사회로를 재설계한다. (우) 이중모드 CRISPR 유전자 가위 시스템은 세포 대사의 체계적 재설계, 유전자 발현의 정밀 재구성, 다양한 기능을 수행할 수 있는 미생물 균주 구축을 가능하게 하며, 궁극적으로 목표 물질의 생산성을 유의미하게 증대시킨다.
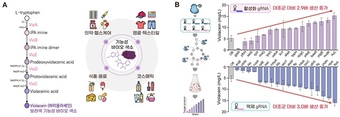
A) 아미노산 L-트립토판을 출발물질로 하여 여러 효소 반응을 거쳐 만들어지는 기능성 바이오 색소 바이올라세인의 생합성 경로를 도식화 하였다. 바이올라세인은 의약·헬스케어, 염료·텍스타일, 식음료, 코스메틱 산업 및 연구 등 폭넓은 산업 및 연구 분야에 응용 가능한 기능성 물질이다. (B) 이중모드 CRISPR 유전자 가위 시스템을 이용한 유전자 활성화·억제 조절 gRNA 대규모 스크리닝 결과, 대조군 대비 rluC 활성화 시 2.9배, ftsA 억제 시 3.0배의 바이올라세인 생산량( mg/L )이 증가함을 확인했다
