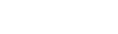Abstract
표적치료는 폐암 치료에 큰 변화를 가져온 획기적인 치료법으로 평가되고 있다. 기존 세포독성 항암치료에 비해 매우 좋은 효과, 적은 부작용과 경구 복용이 가능한 편리함 등으로 생존율 향상과 더불어 삶의 질을 높이는 데 크게 기여하였다.
하지만 일정 기간 이상 투여 시 발생하는 내성 때문에 약제 반응 기간이 한정되는 문제를 안고 있어 이를 극복하기 위한 많은 연구가 진행 중이다. 또한 새로운 표적을 발굴하기 위한 노력도 동시에 진행되고 있어 향후 보다 많은 폐암 환자들이 표적치료의 혜택을 받게 될 것으로 전망된다.
서 론
폐암은 전 세계적으로 발생률, 사망률에서 모두 1위를 차지하고 있는 암으로 5년 생존율이 20%정도에 불과하며 사망하는 전체 암환자의 1/3은 폐암이 원인 일 정도로 예후가 좋지 않다. 이는 수술이 불가능할 정도로 진행된 상태에서 진단되는 경우가 50%를 훨씬 넘을 정도로 많고 이때 사용되는 항암제의 효과가 좋지 않기 때문이다.
지난 40년 동안 항암화학요법은 많은 발전을 해 왔고 그 결과 항암제 투여만으로 완치를 기대할 수 있는 암들도 생겨났으며 많은 암에서 생존율 및 생존기간의 향상이 이루어져 왔으나 폐암은 다른 암에 비해 여전히 치료성적이 좋지 못한 것이 사실이다. 하지만 2000년 대 초반에 등장한 표적항암제는 그 대상이 되는 환자들의 생존기간 을 획기적으로 향상시킴으로써 폐암 치료의 새로운 전기를 마련하게 되었다.
최근 면역항암치료가 등장하면서 그 중요성이 다소 떨어지긴 했지만 표적치료는 폐암에서 가장 중요한 치료의 하나로 자리매김을 하고 있고 내성 극복과 새로운 표적 발굴 등에 대한 연구를 통해 다시 한 단계 진일보하는 계기를 마련할 것으로 생각된다.
본 론
1. 표적항암제 이전의 치료
4기 폐암은 마땅한 치료제가 없던 1970년대에는 평균 생존기간이 3~6개월에 불과하다가 백금화합물 (platinum) 항암제가 처음 도입되면서 6개월을 넘기기 시작하였고 이후 paclitaxel, gemcitabine, vinorelbine 등의 약제가 개발되어 platinum과 병합치료가 시작되면서 (platinumbased doublet chemotherapy) 10개월에 근접한 평균 생존기간을 보여 주었다.
여기에 bevacizumab을 추가한 3제 요법에 의해 처음으로 생존 기간이 1년 이상으로 연장되었고 다음으로 등장한 pemetrexed + platinum 4회 투여 후 독성이 거의 없는 pemetrexed만을 주기적으로 투여하는 유지 요법의 경우 치료성적이 13.9개월으로 가장 좋아 현재까지 표준 치료법으로 이용되고 있다.
2. 1,2세대 EGFR-TKI의 등장
2000년대 초반 다양한 암종에서 EGFR 발현이 증가되어 있고 그 발현의 정도와 예후가 관련되어 있음이 알려지면서 EGFR signal을 억제하여 암을 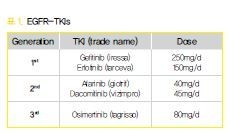 치료하고자 하는 시도가 진행되었다. 그 때 개발된약이 gefitinib (iressaⓇ), erlotinib (tarcevaⓇ)과 같은 경구 복용이 가능한 small molecule, 1세대
치료하고자 하는 시도가 진행되었다. 그 때 개발된약이 gefitinib (iressaⓇ), erlotinib (tarcevaⓇ)과 같은 경구 복용이 가능한 small molecule, 1세대
EGFR-tyrosine kinase inhibitor (EGFR-TKI) 인데 예상과 달리 EGFR 발현이 높은 암종에서는 효과가 없고 발현이 그다지 높지 않고 예후와의 관련성도 별로 없는 폐암의 일부 환자에서만 효과가 있다는 것이 밝혀졌다.
실망스러운 결과이지만 반응이 있던 환자에서는 지금까지 경험해 보지 못한놀랄만한 효과가 나타나 (Lazarus response) 많은 연구자들의 관심을 끌게 되었다. 여성, 선암, 비흡연자, 아시아 환자에서 특히 반응이 좋았고 추가적인 연구를 통해 이들 환자의 폐암에서 EGFR 발현이 아닌 mutation이 문제가 됨을 확인할 수 있었다.
이 후 더 강력하면서 receptor HER family를 다 같이 억제할 수 있는 afatinib (giotrifⓇ), dacomitinib (vizimproⓇ)과 같은 2세대 약제도 등장하였고 1세대 약제 보다 progression-free survival (PFS)가 더 길게 유지되는 효과를 보여 주었지만 전반적으로 약 부작용 또한 더 심한 문제가 있음이 확인되었다.
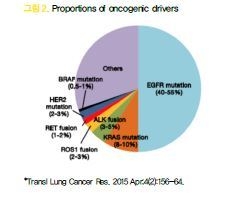
3. EGFR mutations
EGFR mutation은 tyrosine kinase를 코딩하는 exon 18~21에서 발견되는데 이런 변이가 EGFR signal의 증폭을 통해 oncogenic driver로 작동하고 암세포의 생존과 성장이 이 signal에 의존하게 된다. 따라서 EGFR-TKI에 의해 signal이 억제가 되면 암세포가 더 이상 생존하지 못하게 되는데 EGFR signal에 대한 의존성이 높아 IC50 값이 50nM도 안될 정도로 매우 민감하게 반응한다.
30개가 넘는 다양한 변이가 존재하지만 exon 19 deletion과 exon 21 L858R mutation이 대부분을 차지하며 나머지 uncommon mutation은 10% 이내로 알려져 있다. 이들 중 G719X, S768I, L861Q등은 EGFR-TKI에 반응을 하는 mutation이나 다른 uncommon mutation은 반응여부가 아직까지도 확실치 않은 상태이다.
한편 exon 20 insertion 과 de novo T790M mutation은 오히려 EGFRTKI 내성을 나타내는 변이로 확인된 바 있다. 흥미롭게도 EGFR mutation은 서양인에 비해 동양인에서 더 높은 빈도로 발견되고 비흡연자, 선암에서 주로 나타나는데 이들에서 약제 반응이 좋은 것과 잘 일치하는 결과이다.
EGFR mutation은 흡연이 아닌 다른 발암물질에 의해 생기는 것으로 생각되지만 아직까지 정확한 원인을 규명하지는 못한 상태이다. 여성에서 많기 때문에 실내 라돈 가스나 요리 시 나오는 연기, 대기 오염 등과의 관련성에 대해 연구가 진행 중이다.
4. EGFR-TKI 효과
EGFR mutation이 있는 환자에서 기존 약제의 경우 평균 생존기간이 1년이 조금 넘는 수준인반면 EGFR-TKI는 2~3년이 될 정도로 탁월한 효과를 보여 주었고 다른 세포독성 항암제와의 비교임상을 통해 우월성을 입증함으로써 현재 1차 표준치료제로 사용되고 있다. 특정한 표적을 겨냥한 표적치료의 시작은 백혈병 치료제인 imatinib (gleevecⓇ)으로 볼 수 있지만 이 약제는 대상 환자수가 많지 않은 반면 EGFR-TKI는 많은 폐암 환자에 적용이 되면서 본격적으로 표적치료의 시대를 연 약제로 평가되고 있다.
5. 내성의 발현
초기의 좋은 반응에도 불구하고 1년 정도 투약하게 되면 대부분의 환자에서 약제내성이 생겨 병이 다시 진행하게 된다. 진화론적인 관점에서 볼 때 재앙적 수준의 갑작스런 환경 변화에서의 생존을 위해서는 개체, 장기 혹은 세포의 다양성이 필수적이며 이는 암세포에서도 마찬가지일 수밖에 없다.
소위 ‘tumor heterogeneity’는 효과적인 치료 약제에 의해 대부분의 암세포가 사멸되는 과정에서도내성을 지닌 극소수의 암세포가 성장해서 병이 다시 진행하는 현상을 설명하는 중요한 개념이 된다.
6. 내성의 기전
EGFR-TKI에 대한 내성을 일으키는 기전들이 그 동안 많은 연구를 통해 밝혀져 왔는데 다음과 같은 3가지로 정리가 될 수 있다. 첫째는 EGFR에 추가적인 변이가 생겨 약 효과를 떨어뜨리는 것이다. 대표적인 것이 exon 20에 생기는 acquired T790M mutation 인데 약제 결합 부위에 이런 변이가 생김으로써 약 결합력을 약화시켜 내성을 가져오는 것으로 이해되고 있다.
내성의 50% 정도를 차지할 정도로 매우 중요한 기전이다. 둘째는 EGFR signal이 억제되어 생존이 어려워진 암세포가 다른 신호전달체계를 활성화시켜 살아남는 것이다. c-MET, AXL, IGFR 등이 알려져 있으며 그 중 c-MET inhibitor가 많이 개발되어 EGFRTKI와 동시 투여해서 내성을 극복하려는 시도가 많 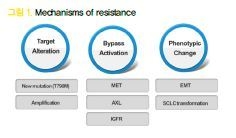 이 이루어지고 있다. 마지막으로 세포의 phenotype이 변화하는 기전을 들 수 있는데 small cell transformation, epithelial-to-mesenchymal transition (EMT) 등이 있다. 내성 후 조직검사에서 small cell transformation이 발견되면 small cell lung cancer 에 준하는 치료를 해야 한다.
이 이루어지고 있다. 마지막으로 세포의 phenotype이 변화하는 기전을 들 수 있는데 small cell transformation, epithelial-to-mesenchymal transition (EMT) 등이 있다. 내성 후 조직검사에서 small cell transformation이 발견되면 small cell lung cancer 에 준하는 치료를 해야 한다.
7. 3세대 EGFR-TKI
가장 많은 내성의 기전인 T790M을 겨냥한 약제의 개발이 오랫동안 진행되어 왔고 그 중osimertinib (tagrissoⓇ)이 EGFR sensitizing mutation과 동시에 T790M을 효과적으로 억제 하는 것으로 입증이 되면서 현재 1,2세대 EGFRTKI 사용 후 생긴 내성 중 T790M 양성인 경우에 사용되고 있다. 현재 국내의 한 제약사에서 개발한 lazertinib 또한 3세대 약으로 현재 임상시험이 진행 중에 있는데 효과는 osimertinib과 거의 동등한것으로 알려지고 있다.
8. 재조직검사와 liquid biopsy
T790M을 확인하기 위해서는 내성이 생긴 암 조직에서 생검을 다시 해야 하지만 일부 환자에서는 암이 너무 작거나 검사하기가 어려운 위치에 있어 재조직검사가 불가능하거나 검사를 했지만 충분한 암세포를 획득하지 못하여 결국 T790M 여부를 확인하지 못하는 경우도 있다. 각 기관에 따라 차이가 나지만 재조직검사의 성공률은 60~80% 정도이다.
따라서 이를 대체할 방법으로 혈액 내에 존재하는 tumor DNA를 추출해서 검사를 하는 liquid biopsy가 주목받아왔고 임상시험을 통해 검증을 했을 때 검사의 민감도가 조직 대비 60~80% 정도로 비교적 우수한 결과를 보여주어 현재 조직검사가 어려운 환자에서의 T790M 검사에 이용되고 있다.
9. 3세대 약제의 1차 사용
재조직 검사의 실패율, 검사 과정의 위험성등의 문제와 3세대 약이 내성의 절반을 차지하는 T790M을 억제하면서 동시에 sensitizing mutation에도 효과적인 점 등을 감안할 때 이 약제를 1차로 사용했을 때 1,2세대 약을 쓰고 나서 3세대를 투여했을 때와 비슷한 성적을 낼 수 있다면 보다 나은 표준치료법이 될 수 있다.
이를 검증하기 위한 3상 연구에서 (FLAURA study) osimertinib 1차 요법의 median PFS는 18.9 개월로 1,2세대
EGFR-TKI + osimertinib의 19.6 ~ 26.1 개월보다 다소 낮긴 하지만 실제 1,2세대 약을 쓰고 나서 osimertinib이 적용되는 환자가 30~40% 수준임을 감안하면 더 좋은 치료법으로 평가될 수 있겠다. 따라서 현재 치료 가이드라인은 1차 약제로 osimertinib을 우선 고려하도록 권장하고 있다.
10. Osimertinib 내성
표적치료제를 포함한 거의 모든 항암제는 내성으로부터 자유로울 수는 없다. Osimertinib 또한 일정 기간 투여하면 내성이 발생하게 되는데 T790M처럼 이전에 없던 새로운 돌연변이인 C797S가 생기는 기전이 처음 보고 되었다. 3세대약이 결합하는 부위에 돌연변이가 발생함으로써 역시 약제 결합력이 떨어져 내성이 오게 되는 것이다. 하지만 빈도는 높지 않아 20%내외가 될 것으로 추정되고 있다.
이외에도 MET, small cell transformation 등의 다양한 기전이 제시되고 있는데 아직 내성환자의 수가 많지 않아 향후 좀 더 많은 환자를 대상으로 한 연구 결과가 필요하다. T790M 을 겨냥한 약제 개발이 성공한 것처럼 C797S에 효과적인 약을 개발하기 위한 노력도 진행 중이다.
11. EGFR-TKI의 부작용
피부, 점막 등의 상피세포가 EGFR-TKI에 가장 영향을 많이 받기 때문에 rash, paronychia, diarrhea 등의 부작용이 흔하게 생기나 대부분 경미하거나 조절이 가능하기 때문에 큰 문제가 되지않는다. AST/ALT가 올라가는 transaminitis도 마찬가지이다.
부작용 조절이 잘 안 되는 경우에는 용량을 줄이거나 다른 EGFR-TKI로 바꾸는 경우 대부분 해결이 된다. 다만 1% 내외로 발생하는 pneumonitis의 경우에는 드물게 생명을 위협할 정도로 심해지기 때문에 주의를 요한다.
12. ALK fusion 유전자의 발견
만성골수성백혈병의 90% 이상이 philadelphia chromosome에 의해 발생되는 데 이것은 brc과 abl 유전자가 translocation, fusion되어 생긴다. 주로 혈액 암들에서 이런 현상들이 발견되는 반면 고형 암에서는 이런 형태의 변이는 매우 드물었다.
2007년 일본의 Mano group에서 EML4- ALK fusion 유전자가 폐암을 발생할 수 있다는 것을 처음 보고하였고 “non-solid oncogenes in solid tumors”라는 점에서 큰 주목을 받게 되었다. ALK 변이는 비편평상피암의 3~5% 정도를 차지하며 EGFR과 다르게 동, 서양의 지역 간, 남녀 간 발생빈도에 큰 차이가 없으며 비교적 젊은 환자에 더 많은 것으로 보고되고 있다.
13. ALK inhibitors
MET inhibitor로 개발되었던 crizotinib이 ALK도 효과적으로 억제한다는 사실이 밝혀지면서 ALK 변이 환자의 치료제로 처음 승인되었다. 이후에 ceritinib (zykadiaⓇ), alectinib (alecensaⓇ), brigatinib (alunbrigⓇ) 등의 2세대 약들이 차례로 개발되었고 최근 3세대 약인 loratinib도 등장하였다.
현재 폐암의 다양한 subgroup 중 ALK 변이폐암의 예후가 가장 좋은 것으로 확인되고 있는데 alectinib 1차 요법의 경우, median PFS가 25.7개월에 도달할 정도이며 현재 임상 시험이 진행 중인 brigainib, loratinib 1차 요법 성적 또한 많은 기대를 모으고 있다.
14. ALK inhibitor 내성
ALK inihibitor에 대한 내성 기전은 T790M이 주가 되는 EGFR 보다 훨씬 복잡하게 나타난다. 새로운 돌연변이가 원인인 경우는 20~30%로 추정되는데 L1196M, G1269A, C1156Y 등 여러 종류의 돌연변이가 산재되어 있고 2세대 약에 대한 반응도 변이에 따라 조금씩 차이가 난다. Loratinib이 현재까지 가장 많은 변이에 효과적인 것으로 알려지고 있다.
15. 뇌전이 효과
폐암 환자의 생존 기간이 길어지면서 뇌전이 환자의 발생 또한 늘어나고 있다. 많은 1세대 EGFR,
 ALK inhibitor는 blood-brain barrier를 잘 통과하지 못하거나 p-glycoprotein에 의해 약이 배출되면서 뇌에 효과적인 약의 농도가 유지되지 못하여 치료 효과가 부족하다. 따라서 추가적인 방사선치료가 필요하지만 3세대 EGFR-TKI나 2,3세대 ALK inhibitor의 경우에는 뇌 전이에도 뛰어난 효과를 나타내는 것이 확인되어 방사선치료 없이 이런 약제를 투여하는 것도 고려해 볼 수 있다.
ALK inhibitor는 blood-brain barrier를 잘 통과하지 못하거나 p-glycoprotein에 의해 약이 배출되면서 뇌에 효과적인 약의 농도가 유지되지 못하여 치료 효과가 부족하다. 따라서 추가적인 방사선치료가 필요하지만 3세대 EGFR-TKI나 2,3세대 ALK inhibitor의 경우에는 뇌 전이에도 뛰어난 효과를 나타내는 것이 확인되어 방사선치료 없이 이런 약제를 투여하는 것도 고려해 볼 수 있다.
16. ROS1 rearrangement
ALK와 마찬가지로 ROS1도 rearrangement를 통해 fusion 유전자가 만들어 지는데 비편평상피암의 1~2% 정도를 차지하는 드문 변이이다. ALK inhibitor인 crizotinib이 ROS1에도 효과가 있어 현재 1차 치료제로 사용되고 있는데 alectinib을 제외한 다른 ALK inhibior들도 효과가 있는 것이 입증되어 향후 사용이 가능해질 전망이다.
17. BRAF V600E mutation
BRAF V600E mutation 역시 1~2% 정도를 차지하는 드문 변이이고 BRAF inhibitor인 dabrafenib (tafinlarⓇ)이 개발되어 있다. 하지만 BRAF inhibitor 단독으로 사용 시 downstream signal 인 MEK이 활성화 되면서 효과가 감소하는데 MEK inhibitor인 trametinib (mekinistⓇ)을 병용할 때 좋은 효과를 나타내는 것이 확인되어 현재 두 약제의 병용요법이 1차 치료로 승인이 되었다.
결 론
EGFR, ALK, ROS1, BRAF 등을 겨냥한 표적치료로 가장 치료가 어렵던 폐암의 예후가 급격히 향상되었고 많은 약제의 개발과 더불어 임상 시험들이 다양하게 시도되면서 폐암이 암 연구를 선도하고 있는 것으로 평가받고 있다. 빈도가 낮더라도 새로운 표적을 발굴하고자 하는 노력이 지속되고 있고 내성의 문제를 해결하기 위한 연구 또한 활발히 진행되고 있어 향후 보다 많은 폐암 환자들이 표적치료의 혜택을 받게 될 것으로 전망된다.