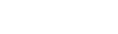서론
우리나라 암 발생률은 2011년 이후 감소를 보이지만 국내 대장암 비율은 해마다 증가하고 있다. 2017년 발표된 중앙암 등록본부 자료에 의하면 2015년 우리나라 남, 여 전체에서 약 20만 건의 암이 발생했는데 그 중 대장암은 남녀를 합쳐 전체의 12.5%로 2위를 차지했다. 대장암의 완치를 위한 유일한 치료는 근치적 절제이나, 전체 환자의 50%는 진행성 혹은 재발성 대장암 환자가 차지하여 궁극적으로는 모두 고식적 항암화학요법의 대상이 된다.
절제 불가능한 전이성 대장암의 치료에는 1970년대 개발된 5-FU 이후로irinotecan, oxaliplatin, capecitabine, TAS-102 등의 5개 항암제와 상피세포 성장인자 수용체(epidermal growth factor receptor, EGFR)나 혈관 내피
성장인자(vascular endothelial growth factor, VEGF), 혈관 내피 성장인자 수용체(VEGF-R) 를 표적으로 하는 표적 항암제로 cetuximab, panitumumab,bevacizumab, aflibercept, regorafenib 등의 5개 표적항암제가 미국 FDA에 인정받아 사용되고 있다. 그리고 DNA 오류 복원력 결핍(mismatch repair deficiency,dMMR)이나 고빈도 현미부수체 불안정(microsatellite instability, MSI-H) 환자들을 대상으로 2017년 면역 관문 억제제(immune checkpoint inhibitor) 인 pembrolizumab 의 효과가 입증되어 미국 FDA에 인정받았다.
본 글에서는 절제가 불가능한 전이성 혹은 재발성 대장암 환자의 치료에 사용되고있는 항암화학요법과 표적치료제의 작용 기전 및 관련된 임상 연구, 실제 임상에서적용하고 있는 치료 지침을 정리하고자 한다.
본론
I. 과거의 치료
절제 불가능한 전이성 대장암의 치료에는 항암화학요법이 주로 사용되고 있다. 1962년 수술이 불가능한 대장암 환자에게 5-fluorouracil(5-FU)을 포함한 치료가 처음 시도되었고, 1980년 대에서는 진행성 대장암환자의 치료에 5-FU와 leucovorin(LV)의 병합 요법이 도입되었다. 현재까지도 5-FU 단독요법이 대장암의 치료에 이용되고 있으며, 5-FU를 근간으로 한 고식적 항암화학요법이 전이성 혹은 재발성 대장암 환자의 생존율과 삶의 질을 통계적으로유의하게 향상시켜주었다.
1990년대에는 oxaliplatin과 irinotecan이 개발되어 5-FU와의 병용요법이 5-FU 단독에 비해 반응율과 생존율을 향상시켜 대장암의 표준화학요법으로 자리잡게 되었고, FOLFOX(oxaliplatin,5-FU, floinic acid) 와 FOLFIRI(irinotecan,5-FU, folinic acid)의 교차투여가 가장 일반적인대장암 치료의 근간을 이뤄졌다. 이들의 조합으로
전이성 대장암 환자들은 약 20개월의 생존기간을 기록했다. 특히 최근에는 항암요법과 함께 발전된 표적치료제들을 통해 30개월 이상의 전체 생존기간이보고되고 있다.
II. 표적치료제
세포독성 항암제와 달리 표적치료제는 정상세포에는 해를 덜 주면서 특정 암세포에만 많이 나타나는특정 단백질 혹은 유전자 변화를 표적으로 암세포의성장과 발생에 관여하는 신호를 차단함으로써 선택적으로 암세포를 공격하는 치료약제를 포괄하여 지칭한다.
1. 상피세포 성장인자 수용체 (EGFR) 차단제
상피세포 성장인자 수용체(epidermal growthfactor receptor, EGFR)는 세포막에 존재하는 단백질로서 세포 내 티로신 키나제 도메인(tyrosinekinase domain)을 갖고 있다. 리간드가 EGFR에 결합하면 티로신 키나제가 활성화되어 신호전달이 일어나고 결과적으로 암세포에서는 세포의 증식, 전이, 신생 혈관의 생성 등이 일어난다.
A. 1차 치료 (first-line treatment): RAS 야생형
얼비툭스(cetuximab)는 대표적 EGFR 단일클론 항체로서, EGFR에 경쟁적으로 결합하여 세포증식을 억제하는 목적으로 쓰인다. 단, 얼비툭스는 K-RAS 유전자 돌연변이 대장암 환자에서는 효과가 없기 때문에, 야생형 K-RAS 유전자를 가진 대장암에서 항암화학요법과의 병용요법으로 2009년 미국 FDA 승인 받았다.
CRYSTAL 연구에서는 K-RAS 야생형 환자에서 1차약제로 FOLFIRI에 얼비툭스를 추가할 경우 무진행 생존기간 8.9개월 vs 9.5개월, 전체 반응률 38.7% vs 46.9%로 우월한 성적을 보였다. 비슷한 연구가 유럽과 중국에서 진행되었는데(OPUS, TAILOR), K-RAS 야생형 전이성 대장암환자에서 1차치료로 얼비툭스와 FOLFOX의 병합 치료를 한 군과 FOLFOX 단독 치료를 한 군을 비교하였을 때, 병합 치료군이 전체반응율, 무진행생존기간 모두 우월하게 향상시켰다.
이러한 결과를 토대로 우리나라에서는 2014년 3월부터 얼비툭스와 FOLFIRI 병용요법으로 EGFR양성, 야생형 KRAS 유전자를 가진 전이성 직결장암 1차 치료 요법으로 급여 인정을 받았으며, 최근 2017년 5월 1일부터 보험급여 확장 적용되어 기존1차 치료로 인정되던 FOLFIRI 병용요법뿐 아니라 FOLFOX 병용요법도 투여가 가능하다.
벡티빅스(panitumumab)는 EGFR에 대한 완전 인체형 단클론 항체이며 작용기전은 얼비툭스와 유사하다. PRIME 연구에서는 RAS 돌연변이 (K-RAS 또는 N-RAS)가 없는 전이성 대장암환자를 분석하였고, 벡티빅스와 FOLFOX의 병합 치료가 FOLFOX 단독 치료보다 전체 생존기간(OS: 26.0 vs. 20.2개월, HR 0.78, p=0.04)과 무질병생존기간(PFS: 10.0 vs. 7.9개월, HR0.72, p=0.004)을 유의하게 향상시키는 결과를 보였다. 이로서 벡티빅스는 2014년 5월 K-RAS (exon2) 정상 유전자를 가진 전이성 대장암 환자에서 FOLFOX와 병용하는 1차 약제로 미국 FDA 허가를 받았다.
B. 부작용
얼비툭스와 벡티빅스의 주요 부작용은 여드름 양피부발진(60-85%)이며, 10-20%에서는 중등도 이상의 피부발진이 나타날 수 있다. 건조제, 국소 항균제, 국소 스테로이드 등을 사용하는 보존적 치료가 권장된다. 드물게 얼비툭스 투여 받은 환자 중심각한 주입반응(3% 미만)이 나타날 수 있으나 벡티빅스 치료를 받은 환자에서는 거의 나타나지 않는다.
2. 혈관생성 억제제
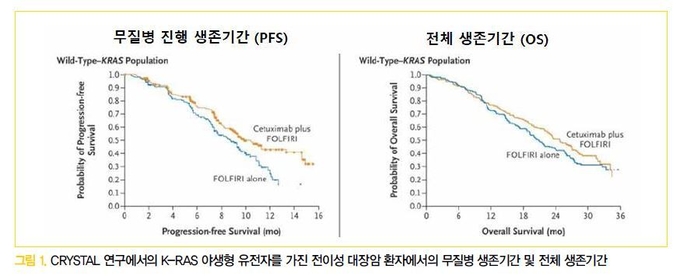
암세포는 여러 가지 성장인자를 분비하는데, 그중 하나가 자신에 필요한 혈관을 생성하는 혈관 내피 성장인자(vascular endothelial growth factor,VEGF)이다. 전이성 대장암에서 허가된 혈관생성 억제 단일클론항체는 아바스틴(bevacizumab), 잘트랩(aflibercept), 스티바가(regorafenib)가 있다.
① 아바스틴 (Bevacizumab)
A. 1차 치료(first-line treatment)
이중 먼저 가장 널리 사용되고 있는 아바스틴은VEGF-A에 대한 단일클론항체로 전이성 대장암의일차 치료제로 항암제와 병용요법으로 사용되고 있다. 치료받지 않은 전이성 대장암 환자들을 대상으로 IFL(irinotecan, 5-FU, LV)과 아바스틴 병용시 효과를 비교한 대규모 2상연구(AVF2107) 결과에 따르면 15.5개월에서 20.3개월로 중앙 생존기간이 유의하게 증가하였다.
또한 전이성 대장암 환자의 초치료로 아바스틴과 FOLFIRI와 FOLFOX의 병합요법 효과를 비교하는 연구(WJOG4407G)가 일본에서 진행되었는데, 양 군에서 무병 생존율과 전체 생존율에 유의한 차이를 보이지 않았다. 이상의 결과를 정리하면, 아바스틴과 FOLFIRI 또는FOLFOX 기반 항암화학약물의 병합 요법은 전이성 대장암 환자의 1차 치료로 효과적인 치료 방법이라고 할 수 있겠다.
B. 2차 치료(second-line treatment)
최근에 제기되는 한 가지 이슈는 아바스틴을 1차요법에 실패한 이후에도 계속해서 사용할 것인가에 대한 것이었다. 그 근거로 전이성 대장암 환자의 1차치료로 아바스틴을 포함한 병합 치료 후 악화되었던 환자들을 대상으로, 아바스틴을 지속하면서 병합 요법을 변경하여(FOLFOX ↔ FOLFIRI) 분석하였던 연구(ML18147)에서는, 병합 치료가 단독치료에 비해 전체 생존기간(11.1 vs. 9.8개월, HR0.81, p=0.0062)과 무질병생존기간(5.7 vs. 4.1개월, HR 0.68, p<0.001)을 향상 시키는 결과를 보여주었다.
정리하면, 아바스틴은 국내에서 RAS 돌연변이 여부와 상관없이 전이성 또는 재발성 대장암에 사용할 수 있으며, 아바스틴은 1차 및 2차 치료제로 5-FU계통의 약물과 함께 처방이 가능하다.
C.부작용
아바스틴 치료 후 발생할 수 있는 부작용은 고혈압, 혈전증, 출혈, 위장관, 천공, 누공 형성 및 복강내 농양, 상처 회복지연, 단백뇨 등이 있다. 대부분의 부작용은 적절한 처치로 조절가능하며, 아바스틴 투여를 중단하면 호전될 수 있다.
② 잘트랩 (Aflibercerpt)
잘트랩은 혈관 속의 VEGF에 결합하여 VEGFtrap으로 작용하여 신생 혈관생성을 억제하는 기전을 가지고 있다. VELOUR 연구에서는 1차 옥살리플라틴 기반의 약물 치료에 반응이 없었던 전이성 대장암 환자들을 대상으로 잘트랩과 FOLFIRI의 병합 치료를 한 군과 FOLFIRI 단독 치료를 한 군으로 나누어 분석하였고, 병합 치료가 전체 생존기간(OS: 13.5vs. 12.1개월, HR 0.817, p=0.0032)과 무질병생존기간(PFS: 6.9 vs. 4.7개월, HR 0.758, p<0.001)을향상시키는 결과를 보여주었다. 현재 우리나라에서는 2017년 6월부터 2차 치료제로서 옥살리플라틴 요법에 실패했을 때 FOLFIRI 항암제와 함께 사용하는것으로 허가되어 사용되고 있다.
③ 스티바가 (Regorafenib)
CORRECT 연구에서는 기존의 약물 치료에 반응이 없었던 전이성 대장암 환자들을 대상으로 스티바가의 효과를 분석하였고, 스티바가를 투여한 군에서 플라시보를 투여한 군에 비해 전체 생존기간(6.4 vs.5.0개월, HR 0.77, p=0.0052)이 향상된 결과를 보였다. 부작용으로는 수족증후군, 피로, 설사, 고혈압, 발진 및 피부 벗겨짐 등이 있었다.
3. EGFR 차단제와 혈관생성 억제제의 비교
이전에 치료받지 않은 RAS 야생형 전이성 대장암 환자에서 1차 항암요법과 병용하는 표적치료제로 EGFR 차단제와 혈관생성 억제제 모두 사용 가능한 치료 옵션이다. 2014년 FIRE-3 3상 연구결과에서도 FOLFIRI 항암요법에 얼비툭스 또는 아바스틴 병용시 무질병 생존기간은 두 군에서 유의한 차이가 없었으며, 또한 CALGB/SWOG 80405 연구에서도 1차 치료로 FOLFIRI/FOLFOX에 아바스틴 또는 얼비툭스를 추가하였을 때 두 군에서 전체생존기간과 무질병생존기간의 유의한 차이를 보이지 못하였다.
결론적으로 RAS 야생형 전이성 대장암 환자에서 1차 표적항암제의 선택에 있어 기존에 발표된 연구 결과들로는 얼비툭스와 아바스틴 두 약제간의 우열을 가리기는 어렵다. 따라서 약제의 부작용이나 환자의 삶의 질 등을 고려해서 표적항암제를 선택할 수있겠다. 또한 기존의 여러 연구들을 통하여 수술 가능한 전이성 대장암에서 선행 보조항암치료로서 표적치료제를 추가 하는 것은 도움이 되지 않는 것으로 입증되었다.
4. 원발 종양 위치에 따른 치료 약제 선택
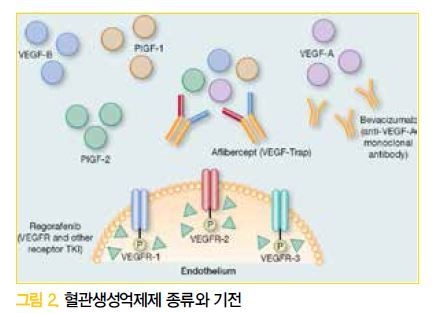
대장암에서 원발 종양의 위치에 따른 예후에 대한 논의는 2001년부터 지속되었지만, 이런 이슈가 좀 더중요하게 대두된 것은 2016년 ASCO 미팅 이후부터이다. Alan P. Venook은 CALGB/SWOG 80405 데이터 세트 이용하여 원발 종양 위치에 따른 효과 차이에 대한 후속연구를 시행하여 2016년 ASCO에서 발표하였다.
특히 얼비툭스를 추가한 치료군에서 원발 종양위치에 따라 치료 효과 차이가 유의하게 보였는데, 우측 대장암 일수록 얼비툭스 치료에 대해 나쁜 예후를보였다. (PFS: 7.8 vs 12.4 개월, HR 1.56, p<0.0001,
OS: 16.7 vs 36.0개월, HR 1.87, P<0.0001)
III. 면역관문억제제 (Immune checkpointinhibitor)
면역관문억제제의 기전은 비교적 간단하다. 암세포는 PD-L1이라는 면역회피물질을 가지고 있으며 이것이 면역세포인 T 세포의 PD-1에 결합하여 면역세포의 기능을 무력화시키고 그 틈을 이용해 암세포는 증식한다. 면역관문억제제는 암세포의 PD-L1과 T 세포의PD-1의 결합을 억제시키는 항체이다.
DNA 오류 복원력 결핍(mismatch repair deficiency,dMMR)은 DNA 복제 시 불일치 오류를 복구하는 단백질이 없거나 그 기능이 손상 됐을 때 나타나며, 이로 인해 대장암을 포함한 특정 암을 일으키는 고빈도 현미부수체 불안정(microsatellite instability, MSI-H) 종양이 발생한다. 전이성 대장암 환자 중 약 5%가 dMMR또는 MSI-H 바이오 마커를 가지고 있으며, 이들은기존 화학요법으로 충분한 치료 효과를 보기 어렵다.
MSI-H 대장암은 MSI로 인한 신생항원에 의하여 돌연변이율이 증가되어 암에 대한 면역반응이 높고, 이로 인
해 면역관문억제제의 효과를 기대할 수 있다.
키트루다(pembrolizumab)는 미국에서 2017년 5월 MSI-H 또는 dMMR 전이성 고형종양에 대한 치료제로 승인되었으며, 전이성 대장암을 포함해 더 광범위하게 승인되었다. FDA가 종양이 시작된 신체부위가 아닌 생체 표지자를 기준으로 암 치료제를 승인한 것은 처음 있는 일이었다. 우리나라에서 키트루다는 2017년 9월부터 MSI-H 또는 dMMR 양성의 전이성 직, 결장암의 3차 이상 치료에서 사용 가능하도록 허가되었다.
결론
기존의 항암약물치료에 EGFR 억제제와 VEGF 억제제와 같은 표적 치료제가 추가되면서 절제가 불가능한 전이성 대장암 환자의 전체 생존율과 무병 생존율이 향상되었다. 하지만 표적 치료제도 결국에는 내성이라는 벽에 부딪히게 될 가능성이 높은데, 표적 치료제 사용 후 내성 획득에 대한 이슈가 최근 몇 년 사이에 주목이 되고 있다.
최근에는 차세대 염기서열 분석법 (next generation sequencing, NGS)이 비약적으로 발전하면서 대장암의 분자생물학적 특징 및 표적 치료제의 효과적인 적용에 대한 다양한 연구들이 시도되고 있으며, 앞으로는 개별 환자의 임상적 특성과 분자생물학적 특성을 분석하여 그 결과에 맞게 치료하는 환자 맞춤형 개별 치료 전략(personalizedtreatment strategy)이 가능할 것으로 보인다.