병원 내 감염의 주요 원인 중 하나로 알려진 슈퍼박테리아 ‘메티실린 내성 황색포도상구균(MRSA, 이하 포도상구균)’은 기존 항생제에 대한 높은 내성뿐 아니라 강력한 미생물막인 바이오필름(biofilm)을 형성함으로써 외부 치료제를 효과적으로 차단한다. 이에 KAIST 연구진은 국제 연구진과 함께 미세방울(microbubble)을 이용해 유전자 표적 나노입자를 전달하여 바이오필름을 무너뜨리고 기존 항생제가 무력한 감염증에 대한 혁신적 해결책을 제시하는 플랫폼 개발에 성공했다.
 KAIST 생명과학과 정현정 교수 연구팀이 미국 일리노이대 공현준 교수팀과의 공동연구를 통해, 포도상구균이 형성한 세균성 바이오필름을 효과적으로 제거하기 위해 유전자 억제제를 세균 내부로 정확하게 전달하는 미세방울 기반 나노-유전자 전달 플랫폼(BTN‑MB)를 개발했다고 29일 밝혔다.
KAIST 생명과학과 정현정 교수 연구팀이 미국 일리노이대 공현준 교수팀과의 공동연구를 통해, 포도상구균이 형성한 세균성 바이오필름을 효과적으로 제거하기 위해 유전자 억제제를 세균 내부로 정확하게 전달하는 미세방울 기반 나노-유전자 전달 플랫폼(BTN‑MB)를 개발했다고 29일 밝혔다.
▲(왼쪽부터) 정주연 석박사통합과정, 정현정 교수
연구팀은 먼저, 포도상구균의 주요 유전자 3종<바이오필름 형성(icaA), 세포 분열(ftsZ), 항생제 내성(mecA)>을 동시에 억제하는 짧은 DNA 조각(oligonucleotide)을 설계하고, 이를 탑재해 균내로 효과적으로 전달할 수 있는 나노입자(BTN)를 고안했다.
여기에 더해, 미세방울(microbubble, 이하 MB)을 사용해 포도상구균이 형성한 바이오필름인 미생물막의 투과성을 높인다. 연구팀은 두 가지 기술을 병용해, 세균의 증식과 내성 획득을 원천적으로 차단하는 이중 타격 전략을 구현했다.
이 치료 시스템은 두 단계로 작동한다. 먼저, 미세방울(MB)이 포도상구균이 형성한 세균성 생체막내 압력 변화로 나노입자(BTN)의 침투를 가능하게 만든다. 이어서, BTN이 생체막의 틈을 타 세균 내부로 침투해 유전자 억제제를 정확하게 전달한다. 이를 통해 포도상구균의 유전자 조절을 일으켜 생체막 재형성, 세포 증식, 그리고 항생제 내성 발현이 동시에 차단된다.
돼지 피부 감염 생체막 모델과 포도상구균 감염 마우스 상처 모델에서 시행한 실험 결과, BTN‑MB 치료군은 생체막 두께가 크게 감소했으며, 세균 수와 염증 반응도 현저히 줄어드는 뛰어난 치료 효과를 확인할 수 있었다.
이러한 결과는 기존 항생제 단독 치료로는 달성하기 어려운 수준이며, 향후 다양한 내성균 감염 치료에도 적용할 수 있는 가능성을 보여준다.
연구를 주도한 정현정 교수는 “이번 연구는 기존 항생제로는 해결할 수 없는 슈퍼박테리아 감염에 대해 나노기술, 유전자 억제, 물리적 접근법을 융합해 새로운 치료 해법을 제시한 것”이라며, “향후 전신 적용 및 다양한 감염 질환으로의 확장을 목표로 연구를 지속할 것”이라고 설명했다.
해당 연구는 우리 대학 생명과학과 정주연 학생과 일리노이대 안유진 박사가 제1 저자로 참여했으며, 국제학술지‘어드밴스드 펑셔널 머터리얼스(Advanced Functional Materials)’에 5월 19일 자로 온라인 게재됐다.
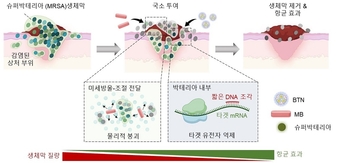
◆슈퍼박테리아 MRSA를 표적하는 유전자 치료제 BTN-MB의 작동 원리 모식도, 규조류 유래 미세방울(MB)을 물리적 전달 촉진체로 활용하고, 생체막 형성(icaA), 세포 분열(ftsZ), 항생제 내성(mecA) 유전자를 동시에 억제하는 짧은 DNA 조각을 탑재한 BTN의 구성 및 작용 메커니즘, MB가 MRSA 생체막을 물리적으로 붕괴시켜 BTN의 효과적 전달을 유도하고, 세균의 생체막 형성 및 증식, 내성 획득을 억제하여 감염 치료 효과를 극대화함, 돼지 피부 감염 생체막 모델 및 MRSA 감염 마우스 상처 모델에서의 치료 적용 결과를 나타낸 개념도
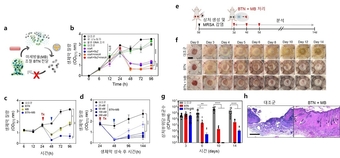
◆유전자 치료제 BTN-MB의 병용처리 효능에 대한 모식도(a) 및 다중 유전자 억제에 따른 슈퍼박테리아(MRSA) 생체막 질량 감소 결과(b), 돼지 피부 감염 생체막 모델에서의 BTN-MB의 시간에 따른 항균 효능(c,d), 쥐의 피부 상처감염 모델에서 BTN-MB에 의한 항균 효능 검증 실험 모식도(e), 쥐의 피부 상처 회복 효과(f)와 상처 부위의 항균 효과(g), 및 조직학적 분석 결과(h)